Les protéines et les peptides sont tous des molécules constituées d’acides aminés. La différence entre les protéines et les peptides réside essentiellement dans le nombre d’acides aminés qui entrent dans leur composition. On parle de peptide lorsque ce nombre d’acides aminés est inférieure à 50 ; et on parle protéine lorsque ce nombre d’acides aminés est supérieure à 50.
Dans ce cours, vous allez découvrir c’est quoi un acide aminé, c’est quoi un peptide et c’est quoi une protéine ? Vous allez aussi comprendre tous les aspects qui se rapportent à ces molécules qui jouent des rôles physiologiques et alimentaires très importants.
Table of Contents
Introduction
Les protéines furent découvertes par le chimiste hollandais Gerhard Mulder (1802-1880). Le terme protéine vient du grec prôtos qui signifie premier, essentiel. Ceci fait probablement référence au fait que les protéines sont indispensables à la vie et qu’elles constituent souvent la part majoritaire du poids sec des organismes (plus de 50% de leur poids sec).
Les protéines sont des macromolécules constituées d’acides aminés, qui, à leur tour, sont composés de carbone, d’hydrogène, d’oxygène, d’azote et parfois de soufre. Ces acides aminés sont liés par des liaisons peptidiques sous forme de longs filaments (chaînes polypeptidiques). Ceux-ci s’enroulent en un nombre quasi infini de formes hélicoïdales ou sphériques, ce qui explique l’immense variété des fonctions assurées par les protéines. Elles sont présentes chez tous les organismes vivants et sont essentielles à leur fonctionnement. On estime qu’il existe environ trente mille protéines différentes chez l’homme, dont 2% seulement ont été décrites.
La forme des protéines est très variable : elle va des longues fibres présentes dans les tissus conjonctifs et les cheveux aux globules compacts et solubles capables de traverser la membrane des cellules. Elles servent à construire et à entretenir les cellules, et leur dégradation chimique fournit de l’énergie, produisant près de 5,7 kilocalories par gramme.
Outre leur rôle dans la croissance et l’entretien des cellules, les protéines sont également responsables de la contraction des muscles. Les enzymes digestives sont des protéines, de même que l’insuline et la plupart des autres hormones, ainsi que les anticorps du système immunitaire et l’hémoglobine. Les chromosomes, qui transmettent toutes les caractéristiques héréditaires sous forme de gènes, sont constitués d’acides nucléiques et de protéines (histones).
Acides aminés
Les acides aminés (ou aminoacides) sont des composés organiques contenant le groupe amino (–NH2) et le groupe carboxyle (–COOH), et sont les constituants fondamentaux des protéines.
Parmi les acides aminés, on distingue ceux qui entrent dans la composition des protéines et sont appelés alpha-aminoacides et ceux qui existent dans la nature mais ne font pas partie de la composition des protéines.
Alpha-aminoacides
Parmi les acides aminés, vingt entrent dans la composition des protéines. Ce sont les alpha-aminoacides, molécules chargées ou électriquement neutres : l’alanine, l’arginine, l’asparagine, l’acide aspartique, la cystéine, l’acide glutamique, la glutamine, la glycine, l’histidine, l’isoleucine, la leucine, la lysine, la méthionine, la phénylalanine, la proline, la sérine, la thréonine, le tryptophane, la tyrosine et la valine.
Ces acides aminés ont la formule semi-développée générale suivante : (Figure 1)

Comme le montre la figure 1 , les groupes amino et carboxyle sont liés au même atome, l’atome de carbone alpha. C’est par le groupe R que les molécules des vingt acides aminés diffèrent les unes des autres. Dans les molécules du plus simple des acides aminés, la glycine, R est un atome d’hydrogène. Les autres acides aminés ont des groupes R plus complexes, constitués d’atomes de carbone, d’hydrogène et, dans certains cas, d’oxygène, d’azote ou de soufre.
Selon la nature du groupement R, on distingue : les acides aminés aliphatiques, les acides aminés aromatiques, les acides aminés hydrophiles, les acides aminés hydrophobes, les acides aminés alcools, les acides aminés soufrés et les acides aminés azotés.
Les acides aminés sont aussi classés selon leur pH isoélectrique, et on distingue trois catégories :
- Les aminoacides acides : Asparagine et acide glutamique (glutamate).
- Les aminoacides basiques : Lysine, arginine, et histidine.
- Les aminoacides neutres : les autres aminoacides.
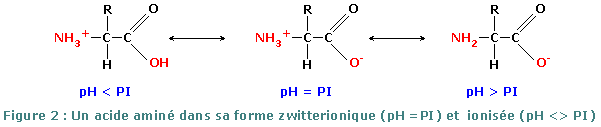
Le pH isoélectrique ou point isoélectrique (pHi ou pI), est le pH où une molécule est sous sa forme zwitterionique (ion mixte), sa charge globale étant alors nulle. Si pH < PI, la charge globale est positive, car la molécule a tendance à conserver ses protons ou à en capter du milieu acide. Si pH > PI, la charge globale est négative, car la molécule a tendance à céder ses protons au milieu basique.
Principaux acides aminés
Sur les tableaux 1 et 2, les acides aminés sont classés selon leur caractère hydrophobe ou hydrophile.
| Nature du groupement R | Formule du groupement R | Nom de l’acide aminé (abréviations) | Propriétés/ Rôle dans la structure des protéines |
|---|---|---|---|
| Aliphatique | H– | Glycine (Gly, G) | Non polaire / Le faible encombrement stérique confère flexibilité à la chaîne protéique |
| Aliphatique | CH3– | Alanine (Ala, A) | Non polaire / Le faible encombrement stérique confère flexibilité à la chaîne protéique |
| Aliphatique | (CH3)2–CH– | Valine (Val, V) | Non polaire / Le faible encombrement stérique confère flexibilité à la chaîne protéique |
| Aliphatique | (CH3)2–CH–CH2– | Leucine (Leu, L) | Non polaire / Le faible encombrement stérique confère flexibilité à la chaîne protéique |
| Aliphatique | CH3–CH2–C(CH3)H– | Isoleucine (Ile, I) | Non polaire / Le faible encombrement stérique confère flexibilité à la chaîne protéique |
| Noyau indole | In–CH2– | Tryptophane (Trp, W) | Non polaire. Le noyau indole (In) absorbe très fortement les UV. |
| Aliphatique (pliée) | (N)–CH2–CH2–CH2– | Proline (Pro, P) | Non polaire / L’hétérocycle (le dernier carbone est relié au N de la fonction amine) confère rigidité à la chaîne protéique |
| Aromatique | Phe–CH2– | Phénylalanine (Phe, F) | Non polaire |
| Groupe soufré | CH3–S–CH2–CH2– | Méthionine (Met, M) | Non polaire |
| Nature du groupement R | Formule du groupement R | Nom de l’acide aminé (abréviations) | Propriétés/ Rôle dans la structure des protéines |
|---|---|---|---|
| Alcool | OH–CH2– | Sérine (Ser, S) | Polaire, non chargé |
| Alcool | CH3–CH(OH)– | Thréonine (Thr, T) | Polaire, non chargé |
| Aromatique | PheOH–CH2– | Tyrosine (Tyr, Y) | Polaire, non chargé |
| Groupe soufré | HS–CH2– | Cystéine (Cys, C) | Polaire, non chargé / Forme des ponts « disulfures » entre les chaînes qui stabilisent la structure. |
| Amide | NH2–CO–CH2– | Asparagine (Asp, N) | Polaire, non chargé |
| Amide | NH2–CO–CH2–CH– | Glutamine (Gln, Q) | Polaire, non chargé |
| Amine | NH2–(CH2)4– | Lysine (Lys, K) | Polaire, chargé positivement |
| Amine | NH=C(NH2+)–NH–(CH2)3– | Arginine (Arg, R) | Polaire, chargé positivement |
| Imidazole | Im–CH2– | Histidine (His, H) | Polaire, chargé positivement |
| Carbonate | COO––CH2– | Aspartate (Asp, D) | Polaire, chargé négativement |
| Carbonate | COO––CH2–CH2– | Glutamate (Glu, E) | Polaire, chargé négativement |
Acides aminés essentiels
La plupart des plantes et des micro-organismes peuvent synthétiser, à partir de composés minéraux, tous les acides aminés qui sont nécessaires à leur croissance. Les animaux, eux, ne peuvent obtenir certains acides aminés que par leur nourriture ; ces acides aminés particuliers sont dits essentiels.
Chez l’homme, les acides aminés essentiels sont en nombre de neuf : la lysine, le tryptophane, la valine, l’histidine, la leucine, l’isoleucine, la phénylalanine, la thréonine et la méthionine. L’histidine est un acide aminé essentiel uniquement pour les enfants. A côté de ces neufs acides aminés, s’ajoutent les acides aminés considérés comme conditionnellement indispensables (indispensables dans certains conditions). Par exemple, la glutamine et l’arginine peuvent devenir indispensables pendant les périodes de stress métabolique.
Les acides aminés essentiels proviennent de l’alimentation. On les trouve dans les aliments d’origine animale, riches en protéines, ou dans des associations de protéines végétales.
Autres acides aminés
Outre les acides aminés contenus dans les protéines, plus de 150 autres ont été trouvés dans la nature ; les groupes carboxyle et amine de certains sont liés à des atomes de carbone différents. On rencontre ces acides aminés inhabituels dans des champignons ou plantes plus complexes.
Peptides
Les chaînes peptidiques sont le produit de la polymérisation covalente des aminoacides par une liaison peptidique. Elles diffèrent par le nombre, la nature et l’ordre des aminoacides. On définit arbitrairement :
- Peptides : enchaînement d’un nombre d’aminoacides inférieur à 50. Parmi ceux-ci, on parle d’oligopeptides pour un nombre d’aminoacides inférieur à 10 et de polypeptides pour un nombre supérieur à 10.
- Protéines : enchaînement d’un nombre d’aminoacides au-delà de 50.
Formation de la liaison peptidique
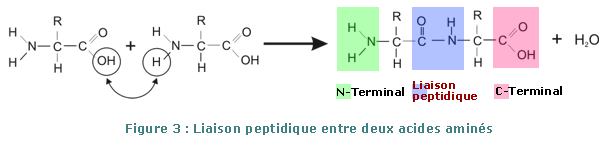
Lorsqu’une cellule vivante synthétise une protéine, le groupe carboxyle d’un acide aminé réagit avec le groupe amino d’un autre acide aminé pour former une liaison peptidique (CO—NH). Le groupe carboxyle du deuxième acide aminé réagit de la même façon avec le groupe amino d’un troisième, et ainsi de suite, jusqu’à la formation d’une chaîne, ou peptide, qui peut contenir de deux à plusieurs centaines d’acides aminés. Les deux aminoacides aux extrémités de la chaîne sont appelés : N-terminal pour celui qui a sa fonction α-aminée libre et C-terminal pour celui qui a sa fonction α-COOH libre.
Hydrolyse de la liaison peptidique
La liaison peptidique est très stable, son hydrolyse spontanée est quasiment nul ; mais elle peut être hydrolysée par voie chimique ou enzymatique.
L’hydrolyse chimique peut être complète ou spécifique :
- L’action de l’acide chlorhydrique (HCl) 6M sur un peptide, à ébullition pendant au moins 24 heures, aboutit à un hydrolysat contenant les aminoacides. Cependant, certains acides aminés comme le tryptophane peuvent être détruits.
- Certains réactifs hydrolysent une liaison peptidique avec une spécificité sur un des aminoacides participant à la liaison. Par exemple, le bromure de cyanogène (BrCN) hydrolyse la liaison peptidique du côté carboxyle de la méthionine et le 2-nitro-5-thiocyanobenzoate (NTCB) hydrolyse la liaison peptidique du côté amine de la cystéine.
L’hydrolyse enzymatique des liaisons peptidiques peut être réalisée par des enzymes protéolytiques (ou protéases ou encore peptidases) qui sont des hydrolases. La spécificité principale de ce groupe d’enzymes est l’hydrolyse des liaisons peptidiques. Leur spécificité secondaire permet de les classer en deux groupes :
- Exopeptidases : Ces enzymes n’hydrolysent que la première liaison peptidique (aminopeptidase) ou la dernière liaison peptidique (carboxypeptidase) en libérant l’aminoacide terminal. Bien évidemment, le processus recommence sur le peptide amputé d’un aminoacide (un temps d’hydrolyse court permet de libérer un seul aminoacide).
- Endopeptidases : Ces enzymes hydrolysent les liaisons peptidiques internes entre deux aminoacides i et (i+1) selon leur spécificité (spécificité du résidu en position i ou i+1). L’hydrolyse d’un peptide par une endopeptidase donnera plusieurs fragments peptidiques : si on a m coupures (m liaisons peptidiques hydrolysées), le peptide sera dégradé en (m+1) fragments peptidiques.
Protéines
Une protéine, aussi appelé protide, est une macromolécule composée par une chaîne (ou séquence) d’acides aminés liés entre eux par des liaisons peptidiques (Figure 3). En général, on parle de protéine lorsque la chaîne contient plus de 50 acides aminés.
Classification des protéines
Plusieurs bases sont utilisées pour la classification des protéines : leur composition chimique, leur rôle biologique dans l’organisme et leur solubilité.
En fonction de leur composition chimique, les protéines peuvent être réparties en deux groupes : les holoprotéines et les hétéroprotéines.
- Les holoprotéines, ou protéines simples, contiennent exclusivement des acides aminés. On les divise en protamines, histones, gluténines, prolamines, albumines, globulines et scléroprotéines.
- Les hétéroprotéines contiennent en plus des acides aminés, une partie non protéique, appelée groupement prosthétique et qui joue un rôle important dans la fonction de la protéine. En fonction du type du groupement prosthétique, ces protéines sont de nouveau divisées en nucléoprotéines, lipoprotéines, glycoprotéines, phosphoprotéines, hémoprotéines, flavoprotéines et métalloprotéines. Les ions métalliques les plus retrouvés dans les métalloprotéines sont le fer, le zinc, le calcium, le molybdène et le cuivre.
En fonction de leur rôle biologique dans l’organisme, on distingue deux grandes classes des protéines : les protéines fibreuses et les protéines globulaires.
- Les protéines fibreuses sont trouvées dans les tissus et les éléments de structure comme les muscles, les os, la peau, les composants ou les membranes cellulaires. Elles accomplissent des tâches structurelles et se composent d’unités aux structures secondaires simples et répétitives (hélice alpha et feuillet bêta). Le collagène et la kératine sont des protéines fibreuses présentant une conformation en hélice alpha, la fibroïne de soie (protéines fibreuses) a une conformation en feuillet plissé bêta.
- Les protéines globulaires jouent un rôle essentiel dans le métabolisme et remplissent plusieurs autres fonctions. Les enzymes, un groupe de protéines possédant une activité catabolique hautement spécifique, constituent un sous-groupe essentiel des protéines globulaires. Les autres protéines globulaires sont les hormones (insuline par exemple), les protéines motrices (par exemple, la myosine du muscle), les protéines de transport (hémoglobine), les protéines de l’immunité dans le sang des animaux vertébrés (par exemple, immunoglobuline) et toutes les protéines principales de stockage (protéines de réserve) comme la glycinine du soja et l’ovalbumine de l’œuf.
En fonction de leur solubilité, on distingue les protéines solubles et les protéines insolubles.
- Les protéines solubles sont divisées en deux groupes : les protéines solubles dans l’eau pure (comme l’albumine) et les protéines qui ne se dissolvent qu’en présence de sels neutres ou dans un milieu légèrement acide ou faiblement alcalin (comme les globulines).
- Quant aux protéines insolubles, comme les scléroprotéines, elles sont insolubles dans tout milieu aqueux.
Structure des protéines
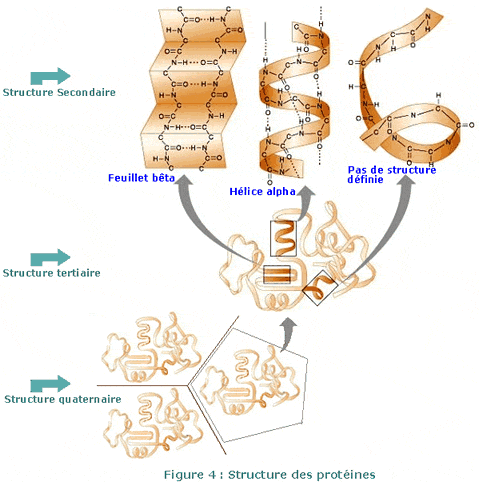
Chaque protéine est formée d’une séquence linéaire de plusieurs acides aminés. Cette séquence (par exemple : Lys-Ala-Ile-Thr-…) détermine ce qu’on appelle «la structure primaire» de la protéine .
Toutefois, une protéine ne garde jamais une forme strictement linéaire. L’énergie contenue dans les liaisons hydrogène, les ponts disulfures, l’attraction entre les charges positives et négatives, et les radicaux hydrophobes ou hydrophiles, imposent à la protéine une structure secondaire, principalement en hélice ou en feuillet. Les molécules deviennent encore plus compactes en adoptant une structure tertiaire. Lorsqu’une protéine est constituée de plus d’une chaîne polypeptidique, comme l’hémoglobine et certaines enzymes, on dit qu’elle a une structure quaternaire (Figure 4).
Dénaturation de la structure des protéines
La structure des protéines est très sensible aux traitements physico-chimiques. De nombreux procédés peuvent conduire à la dénaturation des protéines en affectant les structures secondaire, tertiaire et quaternaire. Les traitements physiques pouvant induire une dénaturation sont le chauffage, le refroidissement, les traitements mécaniques, la pression hydrostatique et les radiations ionisantes . Les interactions avec certains produits chimiques peuvent également dénaturer les protéines : acides et bases, métaux et hautes concentrations salines, solvants organiques, etc.
La dénaturation des protéines est un processus complexe qui induit des changements de conformation (structures secondaire, tertiaire et quaternaire) importants. Au cours du processus de dénaturation, des intermédiaires partiellement instables peuvent apparaître. Chaque modification de structure de la protéine native est appelée dénaturation. La dénaturation des protéines peut être réversible ou irréversible. Les effets de la dénaturation sont variés :
- Modification de la solubilité liée à une exposition différente des unités peptidiques hydrophiles ou hydrophobes,
- Modification du pouvoir de rétention d’eau,
- Perte d’activité biologique par exemple pour les enzymes,
- Augmentation du risque de dégradation chimique à cause de l’exposition des liaisons peptidiques moins stables,
- Modification de la viscosité des solutions,
- Modification ou perte des propriétés de cristallisation.
Exemples de protéines
Histones
Les histones sont des protéines globulaires à caractère basique dû à la présence de forte proportion de lysine et d’arginine. On les rencontre associées aux ADN du noyau des cellules somatiques (cellules qui ne concerne pas la reproduction). Les histones sont solubles dans l’eau et non coagulables par la chaleur. Leur point isoélectrique (pHi) est compris entre 10 et 12.
Protamines
Les protamines sont des protéines de faible poids moléculaire, riches en acides aminés basiques de type arginine et ne contiennent ni soufre ni acides aminés aromatiques. Elles se trouvent associées aux ADN des poissons et des végétaux. Les protamines sont solubles dans l’eau et non coagulables par la chaleur. Leur pHiest compris entre 10 et 12.
Prolamines et gluténines
Les prolamines et les gluténines sont des protéines spécifiques aux végétaux et sont rencontrés particulièrement dans les grains de céréales où elles constituent une partie des substances protéiques de réserve.
Les prolamines sont riches en proline, en aspartate et en glutamate, mais pauvres en lysine et en tryptophane. Leur richesse relative en coline leur attribue la propriété de solubilité dans l’alcool à 70%. La zéine de maïs, la gliadine de blé et l’hordéine de l’orge sont, par exemple, des prolamines. Grâce à leurs structures spiralées et élastiques, ces protéines apportent aux produits de boulangerie du moelleux et une excellente cuisson. Les protéines de la famille des prolamines constituent la fraction toxique chez les intolérants au gluten et principalement l’alpha-gliadine qui est présente dans le froment.
| Céréales | Prolamines | Taux (%) |
|---|---|---|
| Avoine | Avénine | 16 |
| Blé (froment) | Alpha-gliadine | 69 |
| Maïs | Zéine | 55 |
| Millet | Panicine | 40 |
| Orge | Hordéine | 46-52 |
| Riz | Orzénine | 5 |
| Seigle | Sécaline | 30-50 |
Les gluténines ont une composition voisine à celle des prolamines et se distinguent par les proportions contenues en glutamate (un peu moindre dans les gluténines) et en lysine (un peu élevée dans les gluténines). Elles sont insolubles dans l’eau, mais solubles dans les acides et alcalins dilués.
Le gluten (la masse protéique élastique restante après extraction de l’amidon du blé) qui est le constituant principale de la partie protéique des céréales (85% de la quantité des protéines du blé) et un facteur de leur aptitude à la panification, est constitué de ces deux protéines : prolamines et gluténines.
Albumines et globulines
Les albumines et les globulines sont des protéines globulaires (sphéroprotéines) qui se trouvent, aussi bien chez les animaux que chez les végétaux.
Les albumines sont riches en acides glutamique (glutamate), en acide aspartique (aspartate), en lysine et en leucine, mais pauvres en tryptophane. Elles ont un poids moléculaire compris entre 50.000 et 100.000 et un point isoélectrique situé dans la zone acide (pHi < 7). Les albumines sont solubles dans l’eau, coagulables par la chaleur et précipitent par addition de sulfate d’ammonium entre 66% et 100% de saturation. L’ovalbumine du blanc d’œuf, le lactalbumine du lait et la léguméline des légumineuses sont, par exemple, des albumines.
Les globulines sont des protéines qui contiennent toute la série des acides aminés et sont particulièrement riche en glutamate et en aspartate. Les globulines sont insolubles dans l’eau pure mais solubles dans les solutions salines diluées. Elles précipitent par addition de sulfate d’ammonium à 50% de saturation. Ce sont souvent des glycoprotéines ou des lipoprotéines. L’ovoglobuline du blanc d’oeuf et le lactoglobuline du lait sont, par exemple, des globulines.
Caséines
La caséine est une phosphoprotéine riche en lysine (l’un des acides aminés essentiels). Dans le lait, elle se présente sous forme de phophoscaséinate de calcium et représente environ 80% de sa matière protéique et y est présente sous la forme de microparticules en suspension, encore appelées micelles. La caséine est coagulable en milieu acide et par la présure. C’est à la caséine que l’on doit le caillé des fromages (action des ferments et de la présure) et des yaourts (actions des ferments).
À l’état sec, la caséine se présente sous forme d’une poudre blanche, amorphe, insipide et inodore. La caséine se dissout peu dans l’eau, largement dans les solutions alcalines ou dans les acides fort.
Fibroïnes
La fibroïne est une protéine fibreuse riche en glycine et en alanine, mais aussi en sérine et en tyrosine. On la trouve, par exemple, dans la soie et la toile d’araignée.
Kératines
La kératine est une protéine résistante et fibreuse, riche en proline et en cystéine, constituant le matériau principal des téguments (tissus externes de revêtement, comme la peau) et des phanères (productions des épidermes, comme les poils, les ongles, les écailles, les plumes, le bec, les cornes et les sabots) des animaux.
Collagènes
Le collagène est la protéine la plus abondante chez les vertébrés. Il se trouve dans les os, la peau, les tendons et les cartilages. Sa molécule contient habituellement trois longues chaînes polypeptidiques, composées chacune d’environ mille acides aminés. Ces chaînes s’enroulent en une triple hélice régulière, responsable de l’élasticité de la peau et des tendons.
En solution aqueuse et sous l’action du chauffage, le collagène se transforme en gélatine. La gélatine est une substance soluble dans l’eau et donne une solution visqueuse. Outre son utilisation comme colle, la gélatine est utilisée comme gélifiant dans les industries agroalimentaires.
Dégradation des protéines
Contrairement à la dénaturation qui n’affecte que les structures quaternaire, tertiaire et secondaire des protéines ; la dégradation quant à elle touche la structure primaire des protéines et aboutit par conséquent à la formation d’autres produits, parfois indésirables. La dégradation des protéines peut être de nature chimique ou enzymatique.
Dégradation chimique des protéines
La dégradation chimique des protéines peut se produire au cours des processus technologiques ou de préparations culinaires. Les dégradations les plus connues sont :
- Formation d’isopeptides : par chauffage de ponts intramoléculaires ou intermoléculaires entre les fonctions amine-terminal de la lysine et acide-terminal de la glutamine/asparagine. La conséquence de cette réaction est la perte de digestibilité.
- Formation de lysinoalanine : par substitution de la fonction OH de la sérine, ou SH de la cystéine, par la fonction amine-terminal de la lysine suite à un chauffage en milieu basique (blanc d’oeuf cuit). La conséquence de cette réaction est la diminution de la valeur nutritive à cause de la formation d’acides aminés anormaux.
- Réaction de Maillard : Réaction entre un sucre réducteur et un groupement aminé. Cette réaction est la responsable principale de la production des odeurs, des arômes et des pigments caractéristiques des aliments cuits. Elle peut aussi donner naissance à des composés cancérigènes et également réduire la valeur nutritionnelle des aliments en dégradant les acides aminés essentiels. La réaction de Maillard est développée dans la partie relative aux réactions d’altération chimique des aliments.
Dégradation enzymatique des protéines
La dégradation enzymatique des protéines peut intervenir au cours du processus de dégradation biologique des aliments tel que la fermentation ou la putréfaction. Les plus importantes dégradations enzymatiques des protéines sont : la formation d’alcools supérieurs et la formation d’amines biogènes.
Formation d’alcools supérieurs
La dégradation des protéines en alcools supérieurs est un processus enzymatique qui intervient lors de la fermentation alcoolique des fruits, céréales, pommes de terre, etc. La distribution des alcools supérieurs formés est en partie une image de la distribution des acides aminés disponibles. Par exemple, pour la production des eaux de vie, les levures utilisent les acides aminés comme source d’azote ; cette activité conduit à la formation d’alcools supérieurs qui interviennent dans la fraction aromatique des eaux de vie et sont analysés pour l’authentification de ces produits.

Formation des amines biogènes
La formation des amines biogènes intervient lors de la dégradation microbienne des denrées riches en protéines (putréfaction des viandes/poissons, maturation des fromages, fermentations diverses). Cette réaction de décarboxylation d’acides aminés est catalysée par des enzymes (décarboxylases) présentes chez certains bactéries (Proteus morganii, Escherichia coli, Lactobacillus bulgaris, …).

Les amines biogènes sont responsable de plusieurs intoxications alimentaires. La plus dangereuse est l’intoxication scombroïdique due à l’ingestion des produits, notamment les poissons, contenant des doses élevées en histamine. C’est pourquoi la teneur en histamine des poissons est réglementée et doit être contrôlée pour éviter ce type d’intoxication chez le consommateur.
L’histamine se développe dans la chair de plusieurs espèces de poisson suite à la décarboxylation de l’histidine. Cette réaction de décarboxylation est catalysée par l’enzyme histidine-décarboxylase (figure 7). L’histamine est aussi présente naturellement dans divers types d’aliments comme les tomates et les épinards.

Qualité nutritionnelle des protéines
Les protéines alimentaires sont souvent qualifiées de haute ou de basse qualité nutritionnelle en fonction de leur profil en acides aminés. Les protéines de haute qualité nutritionnelle contiennent les 9 acides aminés essentiels dont les proportions sont suffisantes pour couvrir les besoins de l’espèce humaine. Les protéines de qualité moindre sont déficitaires en un ou plusieurs des neuf acides aminés essentiels qui doivent donc être apportés par le reste de l’alimentation.
Propriétés fonctionnelles des protéines alimentaires
Les protéines ont un rôle majeur dans les qualités organoleptiques de nombreux aliments frais ou manufacturés, comme par exemple la consistance et la texture de la viande et produits carnés, du lait et dérivés, des pâtes et du pain. Ces qualités des aliments dépendent très fréquemment de la structure et des propriétés physico-chimiques des composants protéiques ou tout simplement des propriétés fonctionnelles des protéines.
Le terme « propriété fonctionnelle » appliqué aux ingrédients alimentaires est défini comme toute propriété non nutritionnelle qui influence l’utilité d’un ingrédient dans un aliment. Les diverses propriétés vont contribuer pour aboutir aux caractéristiques désirées de l’aliment. Quelques unes des propriétés fonctionnelles des protéines sont : la solubilité, l’hydratation, la viscosité, la coagulation, la texturation, la formation de pâte, les propriétés émulsifiante et moussante.
La propriété de solubilité des protéines
La solubilité des protéines est leur capacité de se dissoudre dans l’eau. Cette solubilité est fonction du pH, de la force ionique et de la température du milieu. La solubilité des protéines est minimale dans une zone de pH située autour de leur point isoélectrique (pI ou pHi). Cette propriété est exploitée pour la préparation des isolats protéiques d’un aliment, par précipitation isoélectrique.
La solubilité des protéines diminue lors des traitements thermiques. Cette perte de solubilité a des conséquences majeures sur les propriétés moussantes et émulsifiantes des protéines.
La solubilité des protéines gagne en importance lorsque la clarté du produit, comme dans les boissons, est capitale.
La propriété d’hydratation des protéines : Rétention de l’eau
La propriété d’hydratation d’une protéine concerne sa capacité à absorber de l’eau. L’absorption et la rétention de l’eau par les ingrédients protéiques jouent un rôle majeur dans la qualité et la texture de divers aliments.
L’absorption de l’eau est influencée par la présence de groupements ionisables, le pH, la présence de sels et la température. La composition en acides aminés influence également la capacité des protéines à absorber de l’eau. Les groupements polaires des protéines (carboxyl, hydroxyl et thiol) ont tendance à lier facilement les molécules d’eau, ce qui contribue à leur capacité d’absorption des molécules d’eau. Au pHi, la capacité des protéines à absorber des molécules d’eau est minimale puisque la charge nette de la protéine est nulle. Une faible concentration en sel dans le milieu améliore l’absorption de l’eau ; toutefois, une forte concentration la diminue. L’absorption de l’eau étant un phénomène exothermique, l’augmentation de la température diminue l’absorption de l’eau.
L’absorption de l’eau des protéines est spécialement importante dans les aliments comme les breuvages, les soupes et les saucisses puisqu’elle joue un rôle déterminant sur la texture (viscosité, gélification) de ces aliments.
La propriété de viscosité des protéines
La viscosité d’une solution protéique est sa propriété qui tend à empêcher son écoulement lorsqu’elle est soumise à l’application d’une force. Les solutions de grande viscosité résistent à l’écoulement et les solutions de faible viscosité s’écoulent facilement.
Des variations de pH, de température et de force ionique peuvent modifier la viscosité des solutions protéiques. Toutefois, elle augmente en milieu alcalin parce que les charges électriques négatives entraînent un déplissement et une élongation maximale de la protéine. Ce phénomène joue un rôle important dans les aliments liquides tels que les boissons, potages, sauces et crèmes.
La propriété de coagulation des protéines
Quand des molécules dénaturées s’agrègent pour former un réseau protéique ordonné, le phénomène est appelé coagulation ou encore, gélification.
La coagulation des protéines est obtenue sous l’action d’agents physiques (température, agitation, …) et chimiques (pH, enzymes, …). L’action de ces agents sur les protéines aboutit à la modification de leur structure et favorise la formation des ponts disulfures entre leurs acides aminés soufrés : c’est la coagulation. Le réseau protéique ainsi formé emprisonne, entre ses mailles, l’eau contenue dans l’aliment ce qui donne à l’aliment son aspect consistant : c’est le gel ou le coagulum.
La propriété de coagulation des protéines est exploitée dans la cuisson des aliments (oeufs, viandes, …) et dans la préparation de nombreux autres produits : les gels protéiques de soja (exemple : tofu), les yaourts, les fromages. Elle est aussi exploitée pour améliorer l’absorption d’eau (épaississement) et pour stabiliser les émulsions et les mousses.
La propriété de texturation des protéines
Les protéines constituent la base de la structure et de la texture de plusieurs aliments. Il existe des procédés de texturation qui conduisent à des structures fibreuses ou en forme de film possédant une texture masticable et une bonne capacité de rétention d’eau.
Les protéines texturées possèdent certaines propriétés physiques des viandes et peuvent donc les remplacer, au moins en une partie (charcuterie, hamburger, etc.).
La propriété de formation de la pâte
Au cours du pétrissage de la farine de certaines céréales, tel que le blé, on assiste à la formation d’une pâte extensible (propriété des prolamines) et élastique (propriété des gluténines) : c’est la propriété de formation de la pâte. Cette propriété est exploitée essentiellement dans la fabrication du pain et des biscuits.
La propriété émulsifiante des protéines
Le caractère amphiphile des protéines leur confère la propriété d’être de bons agents tensio-actifs et elles sont donc utilisées pour stabiliser les phases huile/eau d’une émulsion. De nombreux produits alimentaires sont des émulsions (lait, crèmes, glaces, …) et les constituants protéiques jouent un rôle prépondérant dans leur stabilisation.
Les facteurs comme la concentration en protéines, le pH, la solubilité des protéines, la présence de sels ou d’autres solutés de même que la température influencent les propriétés émulsifiantes des protéines.
La propriété moussante des protéines
Sous l’action du barattage d’une solution protéique, les molécules de protéines se dénaturent, se déroulent et emprisonne de l’air. Cette opération conduit à la formation d’une mousse (dispersion d’un gaz dans un liquide) et au foisonnement de la solution (augmentation du volume par ajout d’air).
La propriété moussante des protéines est exploitée dans la préparation de nombreux aliments comme la mayonnaise et les mousses utilisées dans les confiseries. Pour la préparation de ces mousses on utilise souvent les protéines du blanc d’oeuf, mais d’autres protéines tels que les protéines du lactosérum et les protéines du soja possèdent aussi cette propriété moussante.

