C’est quoi la chimie organique
La chimie organique est la branche de la chimie qui étudie les composés du carbone et leurs combinaisons. De nombreuses variétés de substances sont constituées de molécules organiques, comme les aliments, les médicaments, les matières plastiques, etc.
Au sein de la chimie, la chimie organique occupe une place prépondérante, du fait de la variété et du nombre presque illimité de composés à base de carbone. Plus d’un million de corps sont connus et ce nombre ne cesse de croître, et cela bien que les composés organiques ne renferment qu’un très petit nombre d’éléments différents : outre le carbone, on trouve principalement de l’hydrogène, de l’azote, de l’oxygène, des halogènes et, plus rarement, du soufre, du phosphore, etc.
Dans ce document, nous rappelons quelques notions de la chimie organique afin de comprendre les termes qui seront abordés dans les sections relatives à la chimie alimentaire.
Table of Contents
Histoire de la chimie organique
L’histoire de la chimie organique commence avec la découverte des composés du carbone, qui sont à la base de la vie sur Terre.
Au XVIIIe siècle, les chimistes distinguent les substances organiques, issues des êtres vivants, des substances minérales, issues du règne minéral. Ils pensent que les premières sont dotées d’une force vitale qui les rend irréductibles aux lois de la chimie. Cette idée est remise en cause par le chimiste allemand Friedrich Wöhler, qui synthétise en 1828 l’urée, un composé organique, à partir de cyanate d’ammonium, un composé minéral. Il ouvre ainsi la voie à la synthèse de nombreux composés organiques, tels que l’éthanol, l’acide acétique ou la benzine.
Au XIXe siècle, les chimistes s’attachent à déterminer la structure et la réactivité des molécules organiques, en utilisant des méthodes d’analyse élémentaire, de dégradation et de substitution. Ils établissent des règles de nomenclature et de classification des composés organiques, en fonction de leurs groupes fonctionnels. Ils découvrent aussi les notions d’isomérie, de stéréochimie et de réaction de polymérisation.
Au XXe siècle, la chimie organique se développe considérablement, grâce aux progrès de la spectroscopie, de la chromatographie et de la résonance magnétique nucléaire, qui permettent d’élucider la structure et la configuration des molécules organiques complexes. La chimie organique devient une science fondamentale et appliquée, qui intervient dans des domaines variés comme la biochimie, la pharmacie, l’agroalimentaire ou les matériaux.
Hydrocarbures
Les hydrocarbures sont des composés organiques constitués de carbone et d’hydrogène. Ce sont les composés organiques les plus simples de la chimie organique, et on peut considérer que les autres composés organiques en sont dérivés. Les hydrocarbures présentent une grande importance commerciale : on les utilise comme carburants, comme combustibles, comme huiles lubrifiantes et comme produits de base en synthèse pétrochimique.
On distingue les hydrocarbures aliphatiques (à chaîne ouverte) et les composés cycliques. Dans les composés à chaîne ouverte contenant plusieurs atomes de carbone, ceux-ci sont reliés les uns aux autres pour former une chaîne ouverte pouvant présenter une ou plusieurs ramifications. Dans les composés cycliques, les atomes de carbone forment un ou plusieurs cycles fermés. Ces deux groupes sont subdivisés en composés saturés (ne contenant que des liaisons simples) et insaturés (contenant au moins une double liaison).
Hydrocarbures aliphatiques
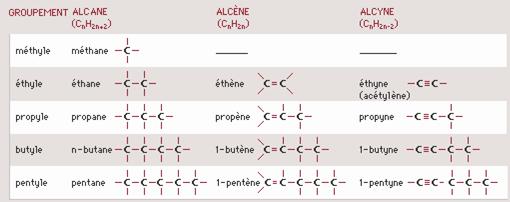
Les hydrocarbures aliphatiques sont des composés contenant plusieurs atomes de carbone reliés les uns aux autres pour former une chaîne ouverte pouvant présenter une ou plusieurs ramifications. Selon la nature des liaisons Carbone-Carbone (saturée ou insaturée), on les classe en alcanes, alcènes et alcynes.
Alcanes
Les alcanes sont des hydrocarbures saturés à chaîne ouverte de formule générale CnH2n+2 (n est le nombre d’atomes de carbone dans la molécule).
Pour désigner les alcanes, on utilise des préfixes grecs indiquant le nombre d’atomes de carbone, suivis de -ane : méthane (CH4), éthane (C2H6), propane (C3H8), butane (C4H10), etc.
Une molécule est dite linéaire lorsque sa chaîne est droite ; elle est ramifiée lorsqu’elle contient des chaînes latérales, ou ramifications.
Alcènes
Les alcènes ou oléfines sont des hydrocarbures insaturés acycliques (aliphatiques) présentant une double liaison carbone-carbone (C=C), de formule générale CnH2n, où n est le nombre d’atomes de carbone dans la molécule. Le premier terme de la série et le plus anciennement connu est l’éthylène (ou éthène, selon les règles de la nomenclature IUPAC), de formule C2H4, de sorte que les alcènes sont souvent appelés hydrocarbures éthyléniques.
La nomenclature appliquée est la même que celle qui concerne les alcanes ; on remplace le suffixe « ane » par « ène », et on indique la position de la ou des doubles liaisons avant le nom de la chaîne principale :
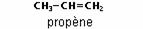
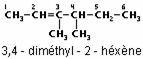
Un composé contenant deux doubles liaisons C=C est un diène, comme par exemple le 3-méthyl-2,4-hexadiène :
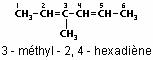
Alcynes
Les alcynes sont des hydrocarbures insaturés acycliques comportant une triple liaison C≡C. Ils ont pour formule générale CnH2n-2 (où n est le nombre d’atomes de carbone dans la molécule).
La nomenclature appliquée est la même que celle qui concerne les alcanes ; on remplace le suffixe « ane » par « yne », et on indique la position de la triple liaison avant le nom de la chaîne principale.
On distingue les alcynes vrais (monosubstitués), de formule générale R–C≡C–H, des alcynes disubstitués qui en dérivent, de formule R–C≡C–R’ (R et R’ étant des groupements alkyles identiques ou différents), en raison des propriétés chimiques de l’hydrogène terminal des alcynes vrais. Les alcynes sont également appelés « hydrocarbures acétyléniques », du nom d’usage du premier terme de la série, l’acétylène (ou éthyne, selon les règles de nomenclature IUPAC), de formule C2H2.
Hydrocarbures cycliques
Les hydrocarbures cycliques font partie des composés organiques les plus importants en chimie organique alimentaire. En effet, plusieurs groupes de ces hydrocarbures constituent les huiles essentielles des plantes aromatiques.
On distingue 2 groupes d’hydrocarbures cycliques : les homocycles et les hétérocycles. Les homocycles ont un cycle formé uniquement d’atomes de carbone ; les hétérocycles présentent un ou plusieurs cycles contenant un ou plusieurs hétéroatomes, éléments différents du carbone et de l’hydrogène (azote, oxygène, soufre, etc.).
Selon la saturation des liaisons carbone, on distingue 2 groupes de d’hydrocarbures cycliques : les cyclanes (cycle saturé), les cyclènes (cycle insaturé C=C) et les cyclynes (cycle insaturé C≡C).
Cycles saturés
De formule brute CnH2n, les cyclanes sont des cycles saturés isomères des alcanes. Les noms que leur donne l’IUPAC sont homologues à la nomenclature utilisée pour les alcanes. Voici deux exemples de cyclanes :
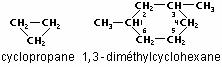
À part le cyclopropane, les cyclanes constituent une partie de l’essence ordinaire. Plusieurs hydrocarbures insaturés cycliques, de formule générale C10H16, se trouvent dans les essences naturelles parfumées qui sont distillées à partir de végétaux. Ces hydrocarbures sont appelés terpènes et comprennent la pinène (dans la térébenthine) et la limonène (dans les essences de citron et d’orange).
Cycles insaturés
Le cycle des cyclènes possèdent une double liaison C=C ; celui des cyclynes, composés très instables, contient une triple liaison C≡C. L’alpha-pinène et la vitamine A sont deux cyclènes :
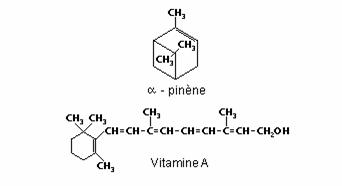
Hétérocycles
Le cycle d’une molécule peut contenir des atomes différents du carbone, appelés alors hétéroatomes. Les hétéroatomes les plus courants sont le soufre, l’azote et l’oxygène. On peut également rencontrer le bore, le phosphore et le sélénium :
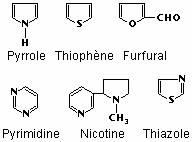
Hydrocarbures aromatiques
Un hydrocarbure aromatique est une substance dont les molécules possèdent un cycle insaturé à six atomes de carbone. Les électrons impliqués dans le cycle sont délocalisés sur tout le cycle. Ainsi, on représente souvent la molécule de benzène comme suit :
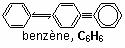
Autres exemples :
Alcools
Les alcools sont des composés organiques comportant le groupe hydroxyle –OH lié à un atome de carbone saturé. La formule générale des alcools est R–OH, où R est un groupement alkyle (CnH2n+1, n étant le nombre d’atomes de carbone dans la molécule). Les alcools font aussi partie des composés les plus important en chimie organique et notamment en domaine alimentaire.
Dans le langage courant, le terme alcool désigne l’alcool éthylique, ou éthanol. Le nom est dérivé de l’arabe al kuhl, ou al koh’l, qui désignait une fine poudre à base de sulfure d’antimoine. Puis, le sens du nom alcool s’est élargi pour désigner toute poudre fine.
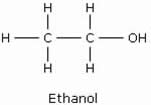
Le nom de l’alcool est formé en ajoutant le suffixe ol au nom de l’hydrocarbure possédant le même nombre d’atomes de carbone que la chaîne principale.
Les alcools qui possèdent un, deux ou trois groupes hydroxyles –OH sont respectivement appelés monoalcool, diols et triols ; s’ils comportent plus de trois groupes hydroxyles –OH, ce sont des polyols. Il existe trois classes d’alcools selon le nombre d’atomes d’hydrogène attachés à l’atome de carbone portant le groupe –OH (carbone fonctionnel) : les alcools primaires, de formule brute RCH2OH, les alcools secondaires R2CHOH et les alcools tertiaires R3COH, les groupes R étant des groupements alkyles.
Enols et phénols
Les énols, composés dans lesquels le groupe –OH est lié à un atome de carbone insaturé ou les phénols dans lesquels ce groupe est lié à un cycle aromatique.
Les énols et les phénols ne sont pas des alcools.
Aldéhydes
Les aldéhydes sont des composés organiques de formule générale R–CHO où R représente soit un atome d’hydrogène, soit un groupe hydrocarboné aliphatique ou cyclique (respectivement groupe alkyle ou aryle).
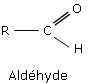
Exemples :

Cétones
Les cétones sont des composés organiques de formule générale R–CO–R’, dans laquelle R et R’ sont des radicaux organiques. La plus simple des cétones est l’acétone, ou propanone, de formule CH3–CO–CH3.
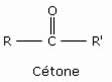
Les aldéhydes, comme les cétones, comportent le groupe fonctionnel C=O, appelé groupe carbonyle. Ces composés carbonylés se distinguent uniquement par le nombre de groupes alkyles ou aryles liés au carbone fonctionnel (un seul pour les aldéhydes et deux pour les cétones). De ce fait, les aldéhydes et cétones présentent de nombreuses analogies.
Exemples :
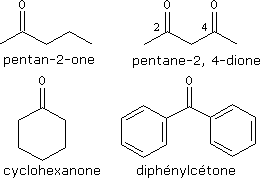
Esters
Les esters sont des composés organiques de formule générale :
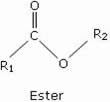
R1 et R2 sont des groupes alkyles ou phényles.
Exemples :
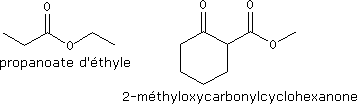
Les esters cycliques sont appelés lactones.
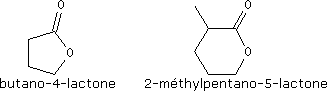
Ethers
Les éthers sont des composés organiques de formule brute générale R1–O–R2, où O est un atome d’oxygène, R1 et R2 sont des radicaux organiques identiques ou différents.
Exemples :
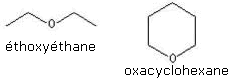
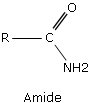
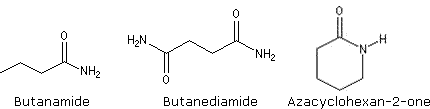
Amides
Les amides sont des composés organiques, contenant le radical CONH2. Les amides forment une grande famille de composés chimiques. Ils sont répandus dans la nature, le plus courant étant l’urée, diamide ne contenant pas d’hydrocarbure. Les protéines et les peptides sont constitués d’amides. Le Nylon est une longue chaîne de polyamide.
Exemples :
Imides
Le groupe fonctionnel d’un imide comporte deux groupes acyles liés au même atome d’azote. Ce sont donc des amides secondaires. On peut les considérer comme les analogues azotés des anhydrides. Les termes les plus importants sont les imides cycliques comme le succinimide ou le phtalimide.
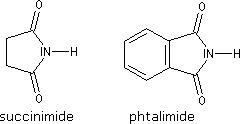
Amines
Les amines sont des composés organiques azotés obtenus par substitution d’un ou de plusieurs atomes d’hydrogène de la molécule d’ammoniac (NH3) par des groupes hydrocarbonés (ou alkyles).
On distingue trois classes d’amines selon le nombre d’atomes d’hydrogène substitués : Les amines primaires, les amines secondaires et les amines tertiaires.
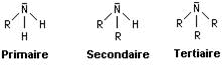
Une amine primaire a pour formule générale R–NH2, une amine secondaire a pour formule (R,R)–NH et une amine tertiaire a trois groupes alkyles (ou aryles) liés à l’atome d’azote. Les acides aminés, composés biologiquement importants, comportent des fonctions amines.
Exemples :
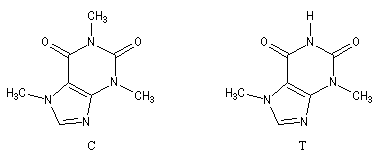
La caféine (C) peut être extraite du café et du thé. La théobromine (T) est contenue dans le cacao.
Nitriles
On appelle nitriles les composés organiques comportant le groupe cyano lié à une chaîne alkyle ou phényle. Ils ont la formule générale suivante : R-C≡N
Exemples :
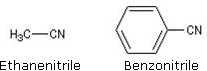
L’éthanenitrile est appelé acétonitrile dans l’industrie. Il est utilisé comme solvant industriel sélectif dans l’extraction des cires et des graisses.
Le benzonitrile ou cyanure de phényle est utilisé comme solvant et comme intermédiaire de synthèse en chimie pharmaceutique.
Acides carboxyliques
Les acides carboxyliques sont parmi les composés les plus important en chimie organique alimentaire. Les acides organiques comme l’acide acétique, l’acide lactique, l’acide oléique sont des acides carboxyliques.
Les acides carboxyliques sont des acides organiques possédant un ou plusieurs groupements carboxyliques (–COOH). L’acide carboxylique le plus simple est l’acide formique (acide méthanoïque). L’acide acétique (acide éthanoïque) nous est familier sous forme diluée : il s’agit du vinaigre.
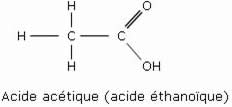
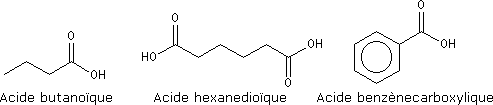
Exemples :
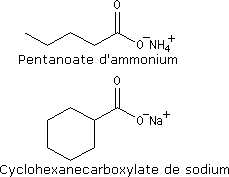
Les noms des ions carboxylate sont formés à partir de ceux des acides parents en remplaçant le suffixe oïque par oate ou le suffixe ique par ate.
Acides aminés
Les acides aminés (ou aminoacides) sont des composés organiques contenant le groupe amino (–NH2) et le groupe carboxyle (–COOH).
Les alpha-aminoacides, constituants fondamentaux des protéines, ont la formule semi-développée générale suivante :
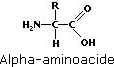
Comme le montre la formule, les groupes amino et carboxyle sont liés au même atome, l’atome de carbone alpha. C’est par le groupe R que les molécules d’acides aminés diffèrent les unes des autres.
Les acides aminés sont aussi parmi les composés les plus important en chimie organique et notamment en domaine alimentaire. En effet, les alpha-aminoacides sont les constituants fondamentaux des protéines.